Hum Brain Mapp | 联合连接矩阵独立成分分析:结构和功能连接的自动链接
对人类大脑连接的研究,包括结构连接(SC)和功能连接(FC),这些方面的研究有助于深入了解大脑功能的神经生理机制及其与人类行为和认知的关系。这两种类型的连接测量都提供了重要且互补的信息。然而,将这两种模式整合到一个单一的框架中仍然是一个挑战,因为它们在数量上的相互依赖性以及由于独特的成像机制而导致的解剖学表征存在差异。本研究引入了一种新的方法——联合连接矩阵独立成分分析(cmICA),该方法利用功
导读
对人类大脑连接的研究,包括结构连接(SC)和功能连接(FC),这些方面的研究有助于深入了解大脑功能的神经生理机制及其与人类行为和认知的关系。这两种类型的连接测量都提供了重要且互补的信息。然而,将这两种模式整合到一个单一的框架中仍然是一个挑战,因为它们在数量上的相互依赖性以及由于独特的成像机制而导致的解剖学表征存在差异。本研究引入了一种新的方法——联合连接矩阵独立成分分析(cmICA),该方法利用功能磁共振成像(MRI)和扩散加权MRI数据的联合分析,同时提供数据驱动的SC和FC信息的分割和自动链接。研究发现,这两种连接模式产生了共同的皮层分离,尽管具有不同程度的(不)相似性。总体而言,数据驱动的联合cmICA为系统、便捷地集成或融合SC和FC提供了一种新方法,为基于连接的大脑多模态数据融合提供了一种有效的工具。
前言
了解人脑中的神经网络组织是神经科学的主要目标之一。大脑计算机制的复杂性意味着它是局部同步和神经元之间更远距离连接结合的产物。神经科学中的术语“大脑连接”通常是指一个大脑神经系统内不同神经元节点之间的结构/解剖联系或功能相互作用的系统模式。这里的节点可以指定为独立的大脑分区、神经元集群,甚至是单个神经元,具体取决于数据。对这些联系和相互作用的更全面的研究可以从数据驱动的方法中受益,这种方法可以识别复杂的空间和时间关系,如相互作用的大脑网络。
近年来,结合功能磁共振成像(fMRI)和扩散MRI(dMRI)的多模态神经成像,使人们更好地了解大脑通信及其对功能整合和分离的调节。白质(WM)束是直接连接功能网络区域并促进区域间信息传播的神经解剖通路。多种脑部疾病研究,例如阿尔茨海默症和痴呆,也表明WM连接的微妙变化可能在很大程度上导致与大脑认知能力下降相关的功能网络受损。因此,利用全脑建模提供结构连接(SC)架构和功能连接脑网络映射的方法,可能在发现潜在的大脑机制方面发挥重要作用。
已经开发了许多方法将dMRI和fMRI数据结合在一起,利用两种模式提供的互补信息。然而,大多数方法单独处理dMRI信息,有时使用它来约束fMRI信息。其他融合方法使用来自一种或两种模式的种子或感兴趣区域(ROI)来关联SC和FC。一些数据驱动的融合方法,例如联合独立成分分析(ICA),多重集典型相关分析(CCA)及其扩展已被应用于基于主体间共变的两种模态的空间分解,但它们通常需要先将模态归纳为特征。因此,仍然需要数据融合方法,该方法可以①提供数据驱动的分割;②自动捕获结构和功能分区之间的空间对应关系,以充分利用每种图像类型中的信息;以及③解决当前方法存在的局限性,以提供更灵活的估计源和连接映射的目标。本文提出的联合连接矩阵ICA(cmICA)是这方面现有工作的自然延伸。
cmICA方法是通过估计群体水平的连接矩阵来提取最大独立的空间源及其与整个大脑对应的连接映射。cmICA最初是为了从dMRI数据中分解示踪成像连接矩阵而开发的,并发现与传统ICA方法相比,cmICA对被试间的细微连接变化、更远距离的区域间连接和空间定位特别敏感。按照最初的方法,研究者使用BOLD数据将cmICA从结构扩展到FC和动态FC。本研究进一步扩展了cmICA以联合提取结构和FC模式中的皮层源分离,并将相应的功能网络和结构网络(即纤维束)连接起来。
方法
被试
被试是通过心理研究网络(MRN)的生物医学研究卓越中心(COBRE,http://cobre.mrn.org)项目招募的。本研究仅使用来自对照被试(n=60,年龄=36.8±12.1岁)的fMRI和扩散MRI(dMRI)数据,这些数据是研究者之前用于分别估计单模态cmICA分析中的结构和FC。在这里,本研究排除了患者,以专注于一般连接模式提取,以及一名未采集两种成像模式的HC被试。所有参与者都在COINS平台(http://coins.trendscenter.org)进行了登记。在纳入研究之前,对被试进行了筛选,以确保他们没有神经或精神疾病以及活性物质使用障碍。
数据采集和预处理
所有被试都在配备12通道射频线圈的3T西门子TIM Trio上进行了扫描。要求被试在休息时睁眼注视中央十字。扩散数据通过单次自旋回波平面成像(EPI)和二次重聚焦平衡回波序列获得的,以减少涡流失真。dMRI序列包括30个方向,i=800s/mm2和b=0的五次测量,采集时间为6min。视场(FOV)为256×256mm,层厚为2mm,72个层,128×128矩阵大小,体素大小=2mm×2mm×2mm,TE=84ms,TR=9000ms,信号采集次数=1,部分傅里叶编码为3/4,GRAPPA加速因子为2。使用FSL软件包(http://fsl.fmrib.ox.ac.uk)进行分析。采用运动校正和涡流校正;由被试运动引起的信号丢失的梯度方向不包括在进一步分析中;利用bedpostx GPU和probtrackx GPU进行ODF扩散参数估计和概率纤维示踪。本研究使用整个大脑上的单个体素作为种子区域和目标区域,而不预定义任何ROI掩膜来提供数据驱动的盲源分离。使用5mm的空间分辨率和每个种子体素的2000条流线来平衡计算速度和性能。在概率纤维示踪成像之后,通过估计每个体素对在其相应矩阵元素内的纤维计数,将全脑体素配对的连接转换为二维连接矩阵。
静息态功能扫描采用T2*加权梯度EPI序列,时间长为5min,150个volumes,具体参数如下:重复时间(TR)=2s,回波时间(TE)=29ms,FOV=240mm,采集矩阵=64×64,翻转角度=75°,体素大小= 3.75×3.75×4.55 mm3,间隙=1.05mm,33个层,升序采集。还通过3D MPRAGE T1序列(矢状面;矩阵=256×256;FOV=256mm;层厚=1mm;无间隙;平面内体素大小=1mm×1mm;翻转角度=7°;TR=2.53s;TE=1.64ms)获得高分辨率解剖结构,为功能扫描提供解剖学参考。使用SPM软件包对fMRI数据进行预处理。丢弃前五个volumes来考虑T1平衡。然后使用INRIalign运动校正算法重新对齐图像。使用中间层作为参考帧进行时间层校正。接下来,将数据在空间上归一化为标准MNI空间,用FWHM 5mm的高斯核进行空间平滑,降采样至5×5×5mm3,以匹配dMRI数据的空间分辨率和几何形状并降低计算复杂度。此外,对数据进行去趋势化、去尖峰化和时域带通滤波(0.001-0.15Hz),以去除噪声源,例如扫描仪漂移、运动尖峰和其他非特异性高频伪影。在本研究中,WM掩膜和灰质掩膜(FSL)用于更准确的皮层分割和WM束提取。对体素时间过程进行归一化处理,以实现cmICA算法的计算优化。注意,时间方差归一化通常是连接或时间调制分析的首选,因为它最大限度地减少了后续数据简化中可能存在的偏差。
连接矩阵独立成分分析
传统的空间ICA通常应用于fMRI数据X,其中按空间划分的时间作为输入。ICA将其分解为独立的空间源S及其对应的时程T,即X=TS。使用个体数据集的时间连接,组水平ICA识别聚合的空间源,这些空间源可以反向投影以估计由个体空间地形图Sk和时程Tk组成的特定被试成分。就cmICA而言,输入连接矩阵C是一个逐个空间矩阵,表示两个大脑区域A和B中所有节点对之间的连接强度。ICA将其划分为区域A中的独立空间源S和区域B中的相应连接映射R,即C=RS。这里,C可以通过全脑灰质(作为A区)和全脑WM(作为B区)的dMRI纤维流线计数定义,因此cmICA生成与每个S相连的灰质区S和WM束映射R。C也可以通过全脑灰质内的时间相关性定义为A区和B区,cmICA生成灰区S及其功能连接映射R。
使用cmICA分离全脑连接矩阵的计算要求很高,因为它需要对整个大脑的voxel-to-voxel相关性(即FC)进行初始计算,然后在这个超大的FC邻接矩阵上进行PCA/ICA。研究者在之前的研究中开发了一种优化的cmICA来解决这个问题。在这里,简要总结了研究者之前工作中的cmICA算法。cmICA最初是在dMRI中使用体素尺度的概率纤维示踪连接矩阵对纤维束进行分区而开发的。然后,研究者将cmICA扩展到fMRI数据集,并推导出当连接矩阵定义为每个体素对的时间互相关时的数值简化。这种优化生成了受FC及其连接空间映射约束的空间源,而无需实际计算单个FC矩阵。
使用ICA将每个被试基于体素的大脑连接矩阵(C=ΣSkRk)分解为源区域B的总和(Sk),及其各自的连接空间映射(Rk)到整个大脑与该源的连接。然而,这里不需要对原始的全脑FC矩阵进行分解,而是将其简化为归一化fMRI时间序列的PCA/ICA,无需对大型FC矩阵进行事先计算。
联合cmICA
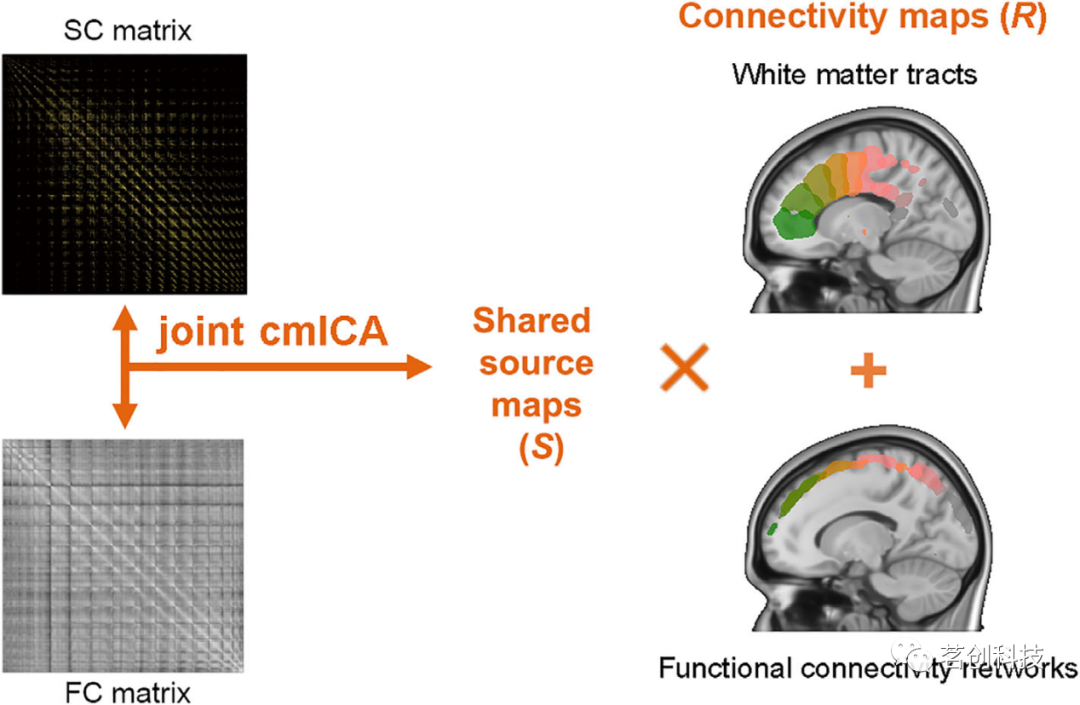
本研究结合两种cmICA,一个是基于时间相关性的FC,一个是基于示踪成像的SC,并将其整合为一个算法(图1)。此外,通过添加GPU计算、快速(稀疏)PCA和超大协方差矩阵优化来增强之前的管道。使用来自全脑fMRI的FC矩阵和来自全脑dMRI的纤维示踪SC矩阵作为联合cmICA的输入。联合cmICA对两种模式之间共享的灰质独立源进行盲源分离。进行了两次PCA,第一次对FC矩阵和SC矩阵的被试水平矩阵进行降维,第二次在执行ICA分离之前分别对两种模式进行组水平数据降维。后一种数据降维平衡了FC和SC数据分布的差异,避免了ICA仅因FC矩阵和SC矩阵之间的方差存在显著差异而从一种模态中选择“源”。最后,联合cmICA生成基于连接的皮层源/分区,这些源/分区在FC矩阵和SC矩阵之间共享。它们的功能连接区域的相应连接图以及连接这些区域的WM区域,使用GICA反向重建和级联顺序在一个估计中联合识别。

图1.联合连接矩阵独立成分分析(cmICA)方法的框架示意图。
模阶选择
本研究为联合cmICA选择了一个相对较高的模型阶数,以有效地捕获来自两种模式的信息,并与研究者之前的工作中所验证过的模型维度相匹配。研究者等人(2010)在COBRE数据中发现了30个可靠WM束的cmICA源。而且从两种模式使用对称的PCA/ICA模型;因此,选择的模型阶数为60。为了确保模阶选择的有效性,使用20次重复运行和随机初始条件的ICASSO来检验ICA训练期间的收敛性,并使用GIFT工具箱(http://trendscenter.org/software/gift)中引入的最小生成树方法来选择最佳运行,以提供一个稳健的和可复制的结果。
特征选择
联合cmICA产生了60个独立的源图,使用以下程序进行进一步处理和可视化。首先,按均值方差对各成分进行排序,即其对输入数据的显著性/贡献。其次,由于FC矩阵和SC矩阵之间存在较大的方差不平衡,因而每种模态对最终cmICA源的贡献将是不同的。为了确保正确选择两种模式的共享源,通过分别平均每种模式的每个成分的荷载绝对值,然后计算从一种模式到另一种模式的比例来计算贡献比。在本研究中,不超过80%和不少于20%的贡献率被认为是有意义的共享成分。本研究还检验了来自两种模式的源地图之间的空间相关性,包括组平均地形图和个体地形图,并确保这些相关性的显著性。同时进行常规运动、成像和生理伪影检查。此外,还比较了从联合cmICA模型生成的源和分别在fMRI和dMRI上估计的单模态cmICA生成的源,以检查皮层分割是否与这两种方法不同。
结果
匹配FC矩阵和SC矩阵的灰质群
联合cmICA产生聚集的灰质S源,以及用FC矩阵和SC矩阵对联合源的“贡献”进行评估。经过反向重建后,使用每种模式的组平均灰质源进行比较和评估。在从特征选择中去除伪影成分和两种模式之间不共享的成分后,选择28个源进行进一步分析。从FC矩阵和SC矩阵中选择28个双S地形图(图2),其余成分请参见补充材料。根据来自SC矩阵的R地形图的链接WM束将源分为五个子类别。图2a-e显示了分别由连合纤维束(CFs)、下纵束(ILF)/下额枕束(IFOF)/钩束(UF)、上纵束(SLF)、扣带束(CG)和皮质脊髓束(CSTs)的WM束连接的灰质源图。为了可视化目的,对每个S图都设置了合适的阈值。计算成分t-统计图,并在t>μ+3σ处设置阈值,μ为空间成分的均值,σ为空间成分的标准差。

图2.灰质来自功能连通性(FC)矩阵和结构连通性(SC)矩阵:(a-e)五种皮层源分别由连合纤维束(CFs)、下纵束(ILF)/下额枕束(IFOF)/钩束(UF)、上纵束(SLF)、扣带束(CG)和皮质脊髓束(CSTs)连接。
尽管在ICA源分离之前,通过选择相同份额的PCA结果来平衡来自两种不同模式的连接输入,但最终结果并不平衡,即每个ICA源都偏向于一种或另一种模式。结果表明,FC矩阵和SC矩阵均按方差和贡献率进行排序后,30个信息源的前半部分来自SC矩阵的贡献率更高,而30个信息源的后半部分来自FC矩阵的贡献率更高。这里的二分法是由两种不同模式的空间分布差异引起的,这两种模式不受平衡方差和缩放等因素的影响。更重要的是,与后半部分相比,30个信息源的前半部分在两种模式之间的贡献率要均匀得多(图3a)。本研究重点关注两种模式中更共享的源,这些信息源通过了贡献率标准(图3a)。此外,每个源对之间的空间相似性如图3b所示。

图3.两种模式间的源贡献率和空间相似性。
匹配FC网络和WM束
本研究发现SC和FC矩阵之间共享较多的成分略微偏向于SC矩阵的贡献。此外,来自SC矩阵的28个成分的连接性R图与研究者之前工作中的WM束非常匹配,研究者将28个空间图分为三个主要功能类别,包括连合纤维(左-右半球皮层),联合纤维(同半球皮层-皮层)和投影纤维(皮层-脊髓,皮层-丘脑),每个类别的名称由“JHU白质纤维束图谱”的20个区域确定。这里联合展示了来自FC矩阵的连接映射R(即FC网络),以及来自SC矩阵的连接映射R(来自共享灰质源S的WM束)。注意,FC网络的R映射与任一模式的S映射不同。这些映射没有像S映射那样具有独立性或平稳性的限制,并且在数学上,它们可以被视为S作为ROI的基于种子的连接图。由于cmICA连接映射R的空间分布不如S明显,因此使用t>μ+2σ对R进行了阈值设置,以便于可视化。
在图4中,CFs定义了穿过胼胝体连接大脑两个半球的纤维。结果发现28个ICA成分中有10个属于这一类。此外,每个定向的连合成分连接着两个半球不同的皮层区域。

图4.连合成分:根据与JHU白质纤维束图谱的数值对应关系,显示了被分组到连合纤维类别中的成分。
基于SC矩阵中这些区域的连接,联合cmICA将胼胝体分割成10个片段,并呈现出一种井然有序的扇形,这与研究者之前(2015)的研究结果和Hofer(2006)基于纤维示踪成像的研究结果一致,但这里胼胝体的分割更为精细。更重要的是,本研究结果还发现了与WM连合纤维相应的皮层FC网络。
联合纤维连接同一大脑半球内的不同部分。这些包括图5a中的ILF,IFOF和UF;图5b中的SLF(颞叶和顶叶)和图5c中的扣带束(CG)。所有这些束在同一半球内纵向连接皮层区域的不同部分,而不是跨越两个半球。左/右成分对以相同的颜色绘制。

图5.联合成分:根据与JHU白质纤维束图谱的数值对应关系,显示了被分组到联合纤维类别中的成分。
在图5b中,顶叶皮层和额叶/中央前皮层在两个半球通过SLF连接。注意,在图5c中,左右CG束(亮热色)都连接到与传统默认模式网络(DMN)相连的ACC和PCC(半透明热色)。DMN的角回在图5c的FC网络中也有显示,但从角回到其他DMN区域的WM束中没有显示连接。这可能是因为①PCA/ICA仅提取了主要的WM束,即高纤维数,而连接角回的WM纤维(在DMN中)连接性更弱/纤维数更少,②提取的WM束和FC网络R映射由源映射S引导。对比图5c和图2d,可以注意到S 21和S 25主要位于FC和SC的前/后CG中,未包括角回;因此,来自SC的R 21和R 25之所以显示扣带,仅仅是因为它是与这些区域结构连接(纤维数)最多的束,但来自FC的R 21和R 25不仅仅限于CG,还包括角回,因为FC网络是基于时间相关的,角回也与S 21和S 25具有高度功能连接(相关)。
投射纤维将皮层与大脑下部和脊髓连接起来,其中包括CSTs。在图6中,CSTs起源于初级运动皮层和躯体感觉皮层,并下传至脑干,是携带运动相关信息的主要途径。跟图5一样,左/右成分对用相同的颜色绘制。

图6.投射成分:根据与JHU白质纤维束图谱的数值对应关系,显示了被分组到投射纤维类别中的成分。
讨论
所提出的联合cmICA方法是从SC和FC信息中提取灰质源,并在一个方案中生成功能网络连接图和WM束连接图。据所知,这是第一个在不提供任何先验信息的情况下,从全脑fMRI和dMRI中联合提取基于连接的信息源的方法。
联合SC和FC
在之前的研究中,最广泛使用的匹配SC和FC的方法包括评估SC和FC矩阵之间的相关性/距离,其中两个矩阵的节点都是预定义的且宏观的。然而,使用cmICA消除了对两种模式的ROI的进行预先选择的需要。ICA在神经成像(特别是在fMRI)中的应用取得了巨大的成功。ICA通常用于通过最大化空间独立性来提取纯数据驱动的源。在本研究中,研究者寻找了既在空间上独立又在SC和FC之间共享最好的皮层源,同时恢复了这些源在FC和SC中的共轭连接分布图,分别生成了FC网络和WM束。这种方法为以数据驱动的方式探索FC和SC的映射开辟了途径,与其他需要聚类先验或投影细节的分割方法相比,这种方法是有用且直接的。
基于ICA的联合分析
利用ICA结合fMRI和dMRI分析的方法并不新鲜。其他方法,如联合ICA,平行ICA,或更广泛的ICA/CCA,亦或是独立向量分析,已被用于寻找两种模式之间的联系。然而,这与本研究提出的方法不同,因为以前的ICA相关方法并不直接涉及“连接”。这些方法使用特征,例如来自fMRI的低频波动图或回归激活图的分数幅度,以及来自dMRI的分数各向异性图或其他张量指标作为多模型分析的输入,并根据被试的负载提取共享信息。这带来了两个潜在的问题。首先,使用不同的特征可能会在多模式源之间产生非常不同的链接。其次,在许多情况下,来自两种模式的链接源在解剖学上没有对齐或连接。以前的方法不会自动链接解剖学和功能信息源,这使得结果的解释和验证更加困难。相比之下,本研究的方法会自动识别来自FC和SC的共享皮层源,以及它们在灰质和WM中的连接映射结果,而不受计算空间限制。
多模态皮层分割
大脑皮层的组织和映射一直是神经科学的一个基本目标,它是人类大脑功能发展、衰老、健康和疾病的模型。这类主题通常使用基于表面的方法进行分析,以揭示皮层的拓扑结构。然而,准确描绘整个皮层区域需要广泛的建模和假设,而较新的方法,如深度学习网络,则需要在大数据规模上进行大量训练,以提高可靠性。相反,本研究方法只做了最少的假设,并给出了皮层组织及其轴突联系的即时视觉视角。此前的研究也表明,利用解剖学、结构、功能、连接和拓扑组织等信息的多模态综合方法在皮层连接分析方面的效果更好,因为每种模态提供了互补的信息和独特优势。在本研究中,结果表明,从前额叶、前运动、运动和感觉,到顶叶、颞枕区的不同皮层区域由横跨胼胝体的不同方向的CF束连接。
结论
本研究提出了一种数据驱动的联合cmICA,可以同时、系统、方便地整合和分析SC和FC,而无需先验图谱。研究结果表明从结构组织和FC中共享皮层分离,尽管有不同程度的(不)相似性。此外,本研究还展示了直接链接这些皮层分割/源的联合结构WM束和FC网络,并在一定程度上解释了结构纤维放电是如何连接功能网络的。联合cmICA结合了SC和FC两种方式,它们可以互为补充。此外,由于连接映射R是从加载参数而不是源中提取的,因此它们不受独立性或平稳性假设的限制。这可能会显著提高捕获健康被试和疾病(例如精神分裂症)中个体差异的敏感性,其中对照组和患者之间的组间差异是非常微妙的,可能无法很好地通过基于特征的ICA模型检测到。总体而言,联合cmICA为基于连接的大脑多模态数据融合提供了一种有效的工具,在研究健康和紊乱的大脑方面都具有巨大的应用潜力。
原文:Joint connectivity matrix independent component analysis: Auto-linking of structural and functional connectivities.
DOI: 10.1002/hbm.26155
更多推荐
 已为社区贡献1条内容
已为社区贡献1条内容









所有评论(0)